Suv расшифровка в медицине
На базе Республиканского диагностического центра г. Астана, Челябинского областного клинического онкологического диспансера проведено клиническое, обсервационное, описательное исследование по типу сообщения о случае на примере 56 больных с диагнозом рак верхних отделов желудочно-кишечного тракта. Локализация патологического процесса в пищеводе отмечена у 16 больных (28,5 %), локализация в желудке – у 40 больных (71,5 %). Целью работы явился анализ уровня коэффициента максимального накопления радиофармпрепарата18F-ФДГ при позитронно-эмиссионной томографии в зависимости от глубины инвазии опухолевого процесса, гистологической структуры и дифференцировки опухоли. При анализе степени поглощения радиофармпрепарата (коэффициент SUVmax) в зависимости от протяженности поражения органа выявлено, что по мере увеличения размеров опухоли отмечается увеличение поглощения радиомодифицированной глюкозы, что свидетельствует о большей активности опухоли. Нами выявлено, что коэффициент SUVmax не зависел от гистологической структуры опухоли. Так, наиболее низкое поглощение радиомодифицированной глюкозы отмечено при аденокарциноме, наибольшее при плоскоклеточном раке. При этом разница средних величин была статистически не значимой (р>0,05). Повышение уровня поглощения глюкозы по мере снижения степени дифференцировки опухоли связано с повышением активности онкологического процесса при низкой степени дифференцировки опухоли. На основании полученных результатов сделан вывод, что коэффициент максимального поглощения радиофармпрепарата18F-ФДГ не зависит от глубины инвазии опухолевого процесса и гистологической структуры опухоли; а зависит от протяженности поражения органа и степени дифференцировки злокачественной опухоли.
1. Гранов А.М. ПЭТ в онкологической клинике / А.М. Гранов, Л.А. Тютин, Костеников // Материалы Х Российского онкологического конгресса. – 2006. – С.46-49.
2. Рязанов В.В., Шевкунов Л.Н. Возможности совмещенной позитронно-эмиссионной и компьютерной томографии в дифференциальной диагностике и стадировании первично выявленных образований пищевода и желудка / В.В.Рязанов, Л.Н. Шевкунов // Материалы Х Российского онкологического конгресса. – 2006. – С.212.
3. Труфанов Г.Е. Совмещенная позитронно-эмиссионная и компьютерная томография (ПЭТ-КТ) в онкологии / Г.Е. Труфанов, В.В. Рязанов, Н.М. Дергунова и др. – М.: ЭЛБИ-СПб, 2005. – С. 126.
4. Тюляндин С.А. Рациональная тактика лечения операбельного рака пищевода / С.А. Тюляндин // Материалы Х Российского онкологического конгресса. – 2006. – С.85-87.
5. Хамзабаев Ж.Х. Лучевая диагностика в онкологии: Современное состояние и перспективы развития / Ж.Х. Хамзабаев // Астана медициналық журналы. – 2012. – № 3(71). – С.22-25.
6. Шаназаров Н.А. Мультидисциплинарный подход к лечению больных с местнораспространенным раком желудка / Н.А. Шаназаров: Автореф. дис. … д-ра мед. наук. – 2010. – 48 с.
7. Brucher B.L. Neoadjuvant therapy of esophageal squamous cell carcinoma: response evaluation by positron emission tomography/ B.L. Brucher, W. Weber, M. Bauer // Ann Surg. – 2001. – № 233. – Р. 300-309.
8. Lordick F. PET to assess early metabolic response and to guide treatment of adenocarcinoma of the oesophagogastric junction: the MUNICON phase II trial / F. Lordick, K. Ott, B.J. Krause // Lancet Oncol. – 2007. – № 8. – Р.797-805.
9. Ott K. Fluorodeoxyglucose-positron emission tomography in adenocarcinomas of the distal esophagus and cardia / K. Ott, W.A. Weber, U. Fink // World J Surg. – 2003. – № 27. – Р.1035-1039.
10. Ott K. Metabolic imaging predicts response, survival, and recurrence in adenocarcinomas of the esophagogastric junction / K. Ott, W.A. Weber, F. Lordick // J ClinOncol. – 2006. – № 24. – Р.4692-4698.
11. Wieder H.A. Time course of tumor metabolic activity during chemoradiotherapy of esophageal squamous cell carcinoma and response to treatment / H.A. Wieder, B.L. Brucher, F. Zimmermann // J ClinOncol. – 2004. – № 22. – Р.900-908.
Актуальность проблемы. В настоящее время большинство онкобольных нуждаются в комбинированном лечении [4,6]. Наблюдаемые у ряда больных неудачи побудили в последнее время шире прибегать к выбору тактики лечения в зависимости от оценки распространенности процесса [3]. Происходит постоянная оптимизация методов для оценки распространения заболевания у пациентов с опухолями пищевода и желудка. Компьютерная томография (КT) представляет стандарт в определении инвазии опухоли. КТ является неинвазивным и наименее дорогостоящим из доступных методов, но имеет серьезные ограничения в плане точной постановки диагноза [5]. Позитронно-эмиссионная томография (ПЭТ) также является неинвазивным, но предоставляет качественно иную информацию по сравнению с КТ, благодаря своей функции участия в метаболическом процессе опухоли, а не только определяя размер опухоли [1]. Многие исследователи показали, что снижение метаболической активности, измеренной значением стандартизированного накопления (SUV) на ПЭТ/КТ, в результате терапии является прогностически значимым критерием [7,9,10]. Следует отметить, что ПЭТ/КТ изображения были изучены у ограниченного количества больных и, согласно другим исследованиям, прогностическая ценность является сомнительной [8,11]. Тем не менее данные ПЭТ/КТ при злокачественных опухолях верхних отделов желудочно-кишечного тракта не были подтверждены [2] и требуют дальнейшего изучения.
Цель работы: выявить зависимость коэффициента максимального поглощения радиофармпрепарата18F-ФДГ от следующих характеристик опухолевого процесса – глубины инвазии опухолевого процесса, гистологической структуры опухоли и степени дифференцировки злокачественной опухоли.
Материалы и методы исследования. В исследование были включены 56 больных с установленным диагнозом или подозрением на злокачественную опухоль верхних отделов желудочно-кишечного тракта, в возрасте от 29 до 89 лет, проходивших обследование на базе отделения радиоизотопной диагностики АО «Республиканского диагностического центра» г. Астана в период с 2010 по 2012 г. Основными критериями включения в исследование явились: наличие или подозрение на злокачественную опухоль желудка или пищевода; проведение позитронно-эмиссионной томографии, совмещенной с компьютерной томографией. Локализация патологического процесса в пищеводе отмечена у 16 больных (28,5%), локализация в желудке – у 40 больных (71,5%). Всем больным проведено ПЭТ/КТ исследование на базе Республиканского Диагностического Центра г. Астана. Позитронно-эмиссионный томограф, совмещенный с 16-срезовым компьютерным томографом GeminiGXL 16 фирмы Philips производства 2008 года. Для проведения ПЭТ/КТ исследования на базе РДЦ создан производственный комплекс, включающий циклотрон «Cyclone 18/9» для производства короткоживущих изотопов, радиохимическая лаборатория для производства радиофармпрепаратов. При проведении ПЭТ/КТ использовался радиофармацевтический препарат «Фтордезоксиглюкоза, 18F, раствор для внутривенного введения». Вводимая доза препарата зависела от площади поверхности тела исследуемого человека. Поверхность тела рассчитывалась по номограмме, исходя из веса и роста больного. Диагностическая доза препарата составляла 220 МБк на 1 м2 поверхности тела пациента; как правило, использовали 300–550 МБк на одно исследование. Препарат вводился внутривенно медленно в объеме 5,0–10,0 мл.
Результаты и их обсуждение. Нами проведен анализ показателя SUVmax в первичной опухоли и определена зависимость коэффициента SUVmax в зависимости от основных характеристик онкологического процесса, таких как глубина инвазии опухолевого процесса, гистологическая структура и дифференцировка опухоли.
Накопление фармпрепарата в первичной опухоли у больных со злокачественными новообразованиями верхних отделов желудочно-кишечного тракта варьировало от 2,1 до 13, в среднем составило 6,25±2,26.
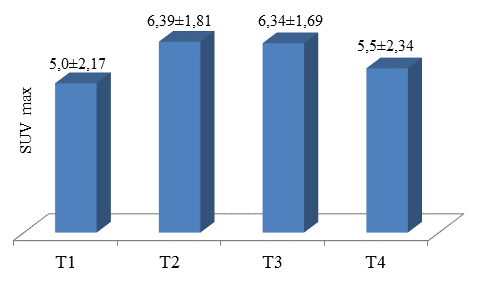
Зависимость максимального накопления радиоизотопа глюкозы от глубины инвазии опухолевого процесса в стенку органа представлена на рисунке 1.
Рисунок 1. Коэффициент SUVmax в зависимости от глубины инвазии опухолевого процесса
Как видно из представленной диаграммы, максимальное накопление радиофармпрепарата не зависело от глубины инвазии стенки органа опухолевым процессом. Наибольшие показатели накопления радиофармпрепарата в первичной опухоли отмечены при прорастании мышечного (Т2, n=27) и серозного (Т3, n=21) слоев. Наиболее низкие показатели отмечены при поражении только слизистого слоя (Т1, n=3) и при прорастании в соседние органы (Т4, n=5). Полученные данные не имели статистически значимых различий (p=0,41).
Проведен анализ содержания радиофармпрепарата ФДГ 18F в зависимости от протяженности поражения органа. Полученные данные представлены в таблице 1.
Таблица 1. Коэффициент SUVmax в зависимости от протяженности поражения органа
Стандартизированный уровень захвата
Стандартизированный уровень захвата (SUV) — это безразмерная величина, представляющая собой отношение удельной радиоактивности в измеряемой зоне или пикселе (C(T)) (кБк/см3) к величине введенной радиоактивности (injection dose) на массу тела patient’s weight (kg) (МБк/кг). SUV = удельная радиоактивность в измеряемой зоне за период времени / ( введенная доза радиоактивного препарата (MBq) / вес пациента в кг ) Стандартизированный уровень захвата отностится к полуколичественным методам и используется для оценки ответа опухоли на проводимое лечение. Более надежным методом оценки уровняактивности считается скорость частичного поглащения (fractional uptake rate, FUR). Поскольку FUR и SUV пропорциональны и связанные с скоростью общего плазматического клиренса использование стандартизированного уровня захвата широко используется для отбора проб крови. Для количественной оценки используется SUVratio или отношение максимального стандартизированного уровня захвата SUVmax в зоне интереса (опухоль) к среднему стандартизированному уровня захвата в неизменной (неопухолевой) ткани SUVmean. SUV (SUV ratio)= SUVmax/SUVmean Стандартизированный уровень захвата может искажаться за счет шумов, низкого разрешения и искажений в области интереса. Граница между доброкачесвтенными и злокачественными характеристиками варьирует в диапазоне 2,0 до 2,5. Чувствительность и специфичность снижается при размерах очага менее 7 мм. В таких случаях рекомендовано повторные исследования.
Литература
- Lucignani G, Paganelli G, Bombardieri E. The use of standardized uptake values for assessing FDG uptake with PET in oncology: a clinical perspective. (2004) Nuclear medicine communications. 25 (7): 651-6. Pubmed
- Hamberg LM, Hunter GJ, Alpert NM, Choi NC, Babich JW, Fischman AJ. The dose uptake ratio as an index of glucose metabolism: useful parameter or oversimplification?. (1994) Journal of nuclear medicine : official publication, Society of Nuclear Medicine. 35 (8): 1308-12. Pubmed
- Huang SC. Anatomy of SUV. Standardized uptake value. (2000) Nuclear medicine and biology. 27 (7): 643-6. Pubmed
- Boellaard R, Krak NC, Hoekstra OS, Lammertsma AA. Effects of noise, image resolution, and ROI definition on the accuracy of standard uptake values: a simulation study. (2004) Journal of nuclear medicine : official publication, Society of Nuclear Medicine. 45 (9): 1519-27. Pubmed
- Thie JA. Clarification of a fractional uptake concept. (1995) Journal of nuclear medicine : official publication, Society of Nuclear Medicine. 36 (4): 711-2. Pubmed
- Thie JA. Understanding the standardized uptake value, its methods, and implications for usage. (2004) Journal of nuclear medicine : official publication, Society of Nuclear Medicine. 45 (9): 1431-4. Pubmed
- Derek Smith , Ki Yap et al. Standard uptake value. Radiopedia.